HUKUM DASAR KIMIA
1. Hukum Lavoisier
Hukum kekekalan Massa dikemukakan oleh Antoine Laurent Lavoisier (1743-1794) yang berbunyi:
”Dalam suatu reaksi, massa zat sebelum dan sesudah reaksi adalah sama”,
dengan kata lain massa tidak dapat diciptakan dan tidak dapat dimusnahkan. Artinya selama reaksi terjadi tidak ada atom-atom pereaksi dan hasil reaksi yang hilang


 Buatlah kesimpulan dari tabel diatas!
Buatlah kesimpulan dari tabel diatas!
3. Hukum Dalthon







1. Hukum Lavoisier
Hukum kekekalan Massa dikemukakan oleh Antoine Laurent Lavoisier (1743-1794) yang berbunyi:
”Dalam suatu reaksi, massa zat sebelum dan sesudah reaksi adalah sama”,
dengan kata lain massa tidak dapat diciptakan dan tidak dapat dimusnahkan. Artinya selama reaksi terjadi tidak ada atom-atom pereaksi dan hasil reaksi yang hilang

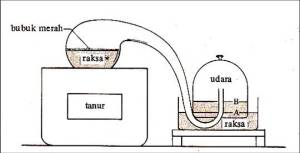
Lavoisier mereaksikan cairan merkuri dengan gas oksigen dalam suatu wadah di ruang tertutup sehingga menghasilkan merkuri oksida yang berwarna merah. Apabila merkuri oksida dipanaskan kembali, senyawa tersebut akan terurai menghasilkan sejumlah cairan merkuri dan gas oksigen dengan jumlah yang sama seperti semula.
Dengan bukti dari percobaan ini Lavoisier merumuskan suatu hukum dasar kimia yaitu Hukum Kekekalan Massa yang menyatakan bahwa jumlah massa zat sebelum dan sesudah rekasi adalah sama.
Syarat:
1. terjadi pada sistem tertutup, sehingga tidak ada zat yang keluar sistem
2. reaktan semua habis bereaksi
Mari berpikir kritis!
Buatlah kesimpulan dari tabel diatas!
2. Hukum Lavoisier
Seorang ilmuwan asal Prancis, Joseph Louis Proust, meneliti perbandingan massa unsur yang terkandung di dalam suatu senyawa pada tahun 1799. Penelitian itu membuktikan bahwa setiap senyawa tersusun atas unsur-unsur dengan komposisi tertentu dan tetap. Oleh karena itu, hukum Proust dikenal sebagai hukum perbandingan tetap. Adapun pernyataan hukum Proust adalah sebagai berikut.
Mari berpikir kritis!
3. Hukum Dalthon
Seorang ilmuwan asal Inggris, John Dalton, melakukan penelitian dengan membandingkan massa unsur-unsur pada beberapa senyawa, contohnya oksida karbon dan oksida nitrogen. Senyawa yang digunakan Dalton adalah karbon monoksida (CO) dan karbon dioksida (CO2). Dari perbandingan keduanya, diperoleh hasil sebagai berikut.

Jika massa karbon di dalam CO dan CO2 sama, massa oksigen di dalamnya akan memenuhi perbandingan tertentu. Perbandingan massa oksigen pada senyawa CO dan CO2 yang diperoleh Dalton adalah 4 : 8 = 1 : 2. Dengan demikian, hukum Dalton dikenal sebagai hukum perbandingan berganda. Berikut ini pernyataan hukum Dalton.

Mari berpikir kritis!
Buatlah kesimpulan dari tabel diatas!
4. Hukum Gay Lussac
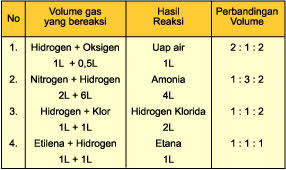
Hukum Gay Lussac dicetuskan oleh ilmuwan asal Prancis, yaitu Joseph Gay Lussac. Lussac meneliti tentang volume gas dalam suatu reaksi kimia. Berdasarkan penelitiannya, Lusac mengambil kesimpulan bahwa perubahan volume gas dipengaruhi oleh suhu dan tekanan. Pada suhu dan tekanan tertentu, 1 liter gas nitrogen bisa bereaksi dengan 3 liter gas hidrogen menghasilkan 2 liter gas amonia. Adapun persamaan reaksinya adalah sebagai berikut.

Adapun pernyataan hukum Gay Lussac adalah sebagai berikut.

Mari berpikir kritis!
Buatlah kesimpulan dari tabel diatas!
4. Hipotesis Avogadro
Hipotesis Avogadro dicetuskan oleh seorang ilmuwan asal Italia, Amadeo Avogadro, pada tahun 1811. Avogadro menyatakan bahwa partikel unsur tidak selalu berupa atom yang berdiri sendiri, melainkan bisa berbentuk molekul unsur, contohnya H2, O2, N2, dan P4. Berdasarkan pemikiran tersebut, Avogadro berhasil menjelaskan hukum Gay Lussac dan membuat hipotesis sebagai berikut.

Mari berpikir kritis!
Buatlah kesimpulan dari gambar diatas!




