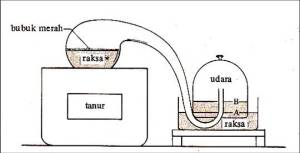
SALAM MERDEKA BELAJARMerdeka belajar yaitu salah satu upaya kemerdekaan dalam berpikir dan berekspresi. Pada dasarnya program merdeka belajar ini memiliki tujuan untuk memerdekakan guru dan siswa. Ini sejalan dengan semangat Ki Hajar Dewantara yaitu memerdekakan manusia khususnya dalam hal pendidikan. Lebih lanjut, simak penjelasan mengenai kurikulum ini.Berikut merupakan...